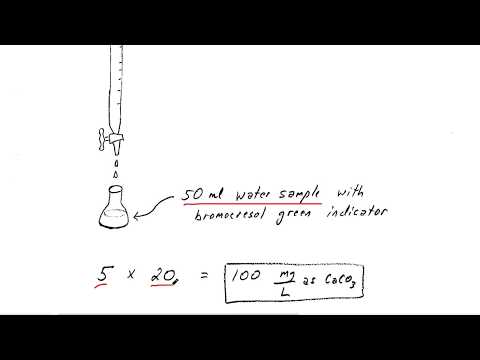
เนื้อหา
- TL; DR (ยาวเกินไปไม่ได้อ่าน)
- ความสำคัญของอัลคาลินิตี้
- หน่วยของอัลคาลินิตี้
- การเตรียมการทดสอบ
- เครื่องมือทดสอบและระเบียบวิธี
- กำลังคำนวณค่าความเป็นด่าง
- การตีความผลลัพธ์
น้ำบริสุทธิ์ไม่มีอยู่จริงในธรรมชาติ แม้ในสภาพแวดล้อมที่ประดิษฐ์ความบริสุทธิ์ของน้ำไม่ได้ผ่านการเปิดขวด น้ำละลายสารมากกว่าของเหลวอื่น ๆ ที่รู้จัก ในความเป็นจริงคนส่วนใหญ่พบว่าน้ำที่ "บริสุทธิ์" มีรสชาติแปลก ๆ ชีวิตขึ้นอยู่กับความสามารถของน้ำในการละลายสารจำนวนมากและสารเคมีที่ละลายในน้ำจะเป็นตัวกำหนดสภาพทางกายภาพที่สำคัญของระบบนิเวศ เงื่อนไขที่เกี่ยวข้องและเกี่ยวข้องกับน้ำที่สำคัญสองประการ ได้แก่ ความเป็นกรดและด่าง
TL; DR (ยาวเกินไปไม่ได้อ่าน)
ใช้สมการนี้เพื่อคำนวณความเป็นด่างในแง่ของ CaCO3: Alk (mg / L CaCO3) = Alk (meq / L) x (1mmol CaCO3me 2meq) x (100.087 มก. CaCO3mm 1mmol CaCO3) = (50044xBxCXCF) ÷ Vs. ตัวแปรที่ใช้คือปริมาตรของกรด (B) ที่ใช้ในการไตเตรทความเข้มข้นของกรด (C)) ปริมาตรน้ำในตัวอย่าง (Vs) และปัจจัยแก้ไข (CF) หากจำเป็น
ความสำคัญของอัลคาลินิตี้
อัลคาลินิตี้กำหนดว่าน้ำต้านทานการเปลี่ยนแปลงค่าพีเอชโดยเฉพาะอย่างยิ่งความต้านทานต่อการกลายเป็นกรด ความเป็นด่างที่สูงขึ้นหมายถึงความต้านทานต่อการเปลี่ยนแปลงค่า pH ที่สูงขึ้น การเปลี่ยนแปลงค่า pH สามารถทำลายล้างระบบนิเวศ พืชและสัตว์น้ำจำนวนมากต้องการช่วงค่า pH ที่แคบมากเพื่อความอยู่รอด สัตว์ที่มีความไวต่อค่า pH น้อยลงจะต้องทนทุกข์ทรมานหากการเปลี่ยนแปลงค่า pH ส่งผลกระทบต่อห่วงโซ่อาหาร นอกจากระบบนิเวศทางธรรมชาติแล้วอัลคาลินิตี้ยังส่งผลกระทบต่อระบบบำบัดน้ำเสียและความเหมาะสมของน้ำเพื่อการชลประทาน อัลคาลินิตี้เรียกว่าความกระด้างของน้ำส่งผลกระทบต่อระบบน้ำในบ้านโดยการสร้างแร่ธาตุในท่อและกระทะรวมถึงการเพิ่มปริมาณของสบู่ที่ผู้คนใช้โดยการยับยั้งฟอง
หน่วยของอัลคาลินิตี้
อัลคาลินิตี้ทำการวัดปริมาณของแคลเซียมแมกนีเซียมและไอออนของกรดอื่น ๆ อัลคาลินิตี้อาจรายงานในรูปของแคลเซียมคาร์บอเนต CaCO3. อัลคาลินิตี้มักวัดและรายงานในรูปของชิ้นส่วนต่อล้าน (ppm) หรือเกรนต่อแกลลอน
การเตรียมการทดสอบ
วิธีที่แนะนำสำหรับการพิจารณาความเป็นด่างนั้นใช้การไตเตรทจุดผัน (IPT) กับสารละลายกรดซัลฟิวริก แม้เมื่อใช้สารละลายกรดซัลฟิวริก 0.01639N ที่มีวางจำหน่ายทั่วไปต้องแน่ใจว่าได้ทดสอบสารละลายกับมาตรฐานโซเดียมคาร์บอเนต ความเข้มข้นของกรดที่แตกต่างกันอาจถูกนำมาใช้โดยเฉพาะอย่างยิ่งเมื่อมีความเป็นด่างต่ำกว่า แต่จะต้องเปรียบเทียบความเป็นกรดกับมาตรฐาน
ตัวอย่างน้ำจำเป็นต้องเป็นตัวแทนของสภาพแวดล้อมดังนั้นการได้รับแสงแดดฝุ่นฝนหรือสารปนเปื้อนอื่น ๆ อาจเปลี่ยนแปลงผลการทดสอบ เมื่อเวลาผ่านไปการเปลี่ยนแปลงของอุณหภูมิอาจส่งผลต่อคุณภาพตัวอย่างดังนั้นควรเก็บตัวอย่างไว้ที่อุณหภูมิของสภาพแวดล้อมดั้งเดิม สำหรับการทดสอบอัลคาลินิตี้กรองตัวอย่างน้ำผ่านเมมเบรน 0.45-µm โดยที่หน่วย µm หมายถึงไมโครมิเตอร์หรือไมครอน ไมโครมิเตอร์เท่ากับ 10-6 เมตรหรือหนึ่งในล้านของเมตร
การทดสอบส่วนใหญ่ใช้ตัวอย่าง 50 มล. (50 มล.) ในบีกเกอร์ 100 มล. แต่สำหรับตัวอย่างที่มีค่าความเป็นด่างต่ำอาจใช้ตัวอย่างขนาดใหญ่ 100 มล.
เครื่องมือทดสอบและระเบียบวิธี
วิธีการทดสอบที่ต้องการนั้นใช้บิวเรตแก้ว แต่อาจใช้เครื่องไตเตรทแบบดิจิทัลก็ได้เช่นกัน ตรวจสอบให้แน่ใจว่าบิวเรตสะอาดและแห้งเพื่อไม่ให้สารละลายกรดเจือจาง
ใช้วิธีการไตเตรทมาตรฐานด้วยความระมัดระวังเป็นพิเศษรอบค่า pH 8.3 และ pH 4.5 สำหรับการค้นหาความเป็นด่างในแง่ของแคลเซียมคาร์บอเนตให้ใช้ความระมัดระวังเป็นพิเศษเนื่องจากค่า pH ตัวอย่างจะเข้าสู่ค่า pH 4.5
กำลังคำนวณค่าความเป็นด่าง
สูตรการคำนวณความเป็นด่างพบว่าอัตราส่วนของกรดต่อจุดสมดุลไบคาร์บอเนต สมการแรกแสดงความเป็นด่างในหน่วยมิลลิวินาทีต่อลิตร
ใช้สูตรนี้เพื่อค้นหาความเป็นด่าง:
Alk (mEq / L) = = ÷ (1000xBxCXCF) ÷ Vs
สมการต่อไปนี้รวมสมการความเป็นด่างเข้ากับปัจจัยการแปลงเพื่อคำนวณความเป็นด่างใน CaCO3:
Alk (mg / L CaCO3) = Alk (meq / L) x (1mmol CaCO3me 2meq) x (100.087 มก. CaCO3mm 1mmol CaCO3) = (50044xBxCXCF) ÷ Vs.
การคำนวณความเป็นด่างต้องรู้:
Alk หมายถึงความเป็นด่าง
B: ปริมาตรของกรดที่ใช้ในการไตเตรทจากค่า pH ดั้งเดิมไปยังจุดที่เทียบเท่า (ใกล้ pH4.5) ในหน่วยมิลลิลิตร
C: ความเข้มข้นของกรดซัลฟิวริกแสดงเป็นปกติ N หรือเป็นมิลลิวินาทีต่อมิลลิลิตร (meq / mL)
Vs: ปริมาตรของตัวอย่างเป็นมิลลิลิตร
CF: ปัจจัยแก้ไขหากจำเป็น ปัจจัยการแก้ไขสำหรับตลับไตเตรทดิจิตอล Hach เท่ากับ 1.01; วิธีการไตเตรทอื่น ๆ ทั้งหมดมีปัจจัยแก้ไขเท่ากับ 1.0
สมมติว่าปริมาณของกรด (B) ที่ใช้เท่ากับกรด 12 มิลลิลิตรความเข้มข้นของกรด (C)) เท่ากับ 0.01639meq / mL และปริมาตรตัวอย่างน้ำ (Vs) เท่ากับ 50 มล. ของน้ำ หากทำการไตเตรทด้วยบิวเรตมาตรฐานค่าการแก้ไข (CF) เท่ากับ 1.0 ในการคำนวณความเป็นด่างให้ใส่ค่าเหล่านี้ลงในสมการแรก การคำนวณกลายเป็น:
Alk = (1000xBxCXCF) ÷ Vs หรือ Alk (meq / L) = ÷ 50mL
การหาค่าความเป็นด่าง: Alk (meq / L) = 3.9 meq / mL
ในการคำนวณความเป็นด่างของแคลเซียมคาร์บอเนตให้ใช้สูตรนี้เพื่อคำนวณความเป็นด่างในความเข้มข้นของแคลเซียมคาร์บอเนต (CaCO3) ใส่ค่าลงในสูตรเพื่อกำหนดความเป็นด่างในรูปของ CaCO3:
Alk (mg / L เป็น CaCO3) = (50044xBxCXCF) ÷ Vs.
การใส่ค่าตัวอย่างสมการจะกลายเป็น:
Alk (mg / L ในฐานะ CaCO3) = ÷ 50mL การแก้สมการให้ Alk (mg / L เป็น CaCO3) = 196.8mg / L
การตีความผลลัพธ์
มิลลิกรัมต่อลิตร (mg / L) เท่ากับส่วนต่อล้าน (ppm) อัลคาลินิตี้เรียกอีกอย่างหนึ่งว่าความกระด้างของน้ำ โดยทั่วไปน้ำที่มีความกระด้างน้อยกว่า 17.0 ppm ถือว่าเป็นน้ำอ่อน น้ำที่มีความกระด้างมากกว่า 180 ppm ถือว่าเป็นน้ำที่แข็งมาก ในตัวอย่างนี้ตัวอย่างน้ำมีความเป็นด่างสูงมาก