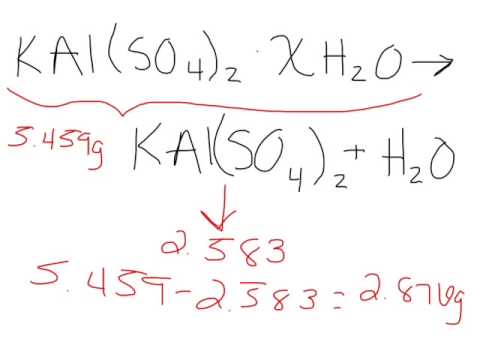
เกลือที่เรียกว่าไฮเดรตจะมีโมเลกุลของน้ำรวมอยู่ในโครงสร้างผลึก หากคุณให้ความร้อนเกลือไฮเดรตคุณสามารถทำให้น้ำที่บรรจุนั้นระเหยไป คริสตัลที่เกิดขึ้นเรียกว่าปราศจากความหมายโดยไม่มีน้ำ ความแตกต่างระหว่างมวลระหว่างเกลือไร้น้ำและเกลือให้ข้อมูลที่คุณต้องการเพื่อหาเปอร์เซ็นต์ของน้ำในน้ำ หากคุณได้ทำการทดลองนี้แล้วและรู้ว่ามวลของเกลือทั้งไฮเดรตและแอนไฮรัสการคำนวณนั้นง่ายมาก
ลบมวลของเกลือปราศจากน้ำออกจากเกลือที่ให้ความชุ่มชื้น ตัวอย่างเช่นหากคุณมีตัวอย่างของคอปเปอร์ (II) ซัลเฟตที่มีน้ำหนัก 25 กรัมก่อนที่คุณจะอุ่นมันและ 16 กรัมหลังจากนั้นให้ลบ 16 จาก 25 เพื่อให้ได้ 9 กรัม
แบ่งความแตกต่างนี้ด้วยมวลของเกลือไฮเดรต ตัวอย่างต่อไปเราจะหาร 9 กรัม 25 กรัมเพื่อให้ได้ 36 เปอร์เซ็นต์ นี่คือเปอร์เซ็นต์ของน้ำในไฮเดรตดังนั้นสิ่งแรกที่คุณอาจต้องคำนวณคือ อย่างไรก็ตามเราสามารถคำนวณข้อมูลอื่นได้เช่นกัน
กำหนดมวลโมลาร์ของเกลือปราศจากรัสโดยใช้ตารางธาตุ ตารางธาตุจะแสดงมวลโมลาร์ของแต่ละองค์ประกอบ คูณมวลโมลาร์ของแต่ละองค์ประกอบในสารประกอบของคุณด้วยจำนวนครั้งที่มันปรากฏในสารประกอบของคุณเพื่อรับมวลโมลาร์ของสารประกอบ
ตัวอย่างเช่นสูตรทางเคมีของแอนไฮดรัสคอปเปอร์ (II) ซัลเฟตคือ Cu (SO)4) มวลโมลาร์ของสารประกอบนี้เท่ากับมวลโมลาร์ของทองแดงบวกกับมวลโมลาร์ของกำมะถันบวกกับมวลโมลาร์ของออกซิเจนสี่เท่า (เนื่องจากมีอะตอมออกซิเจนสี่อะตอมในโมเลกุล) ถ้าเราค้นหามวลฟันกรามของแต่ละอันบนตารางธาตุเราจะพบสิ่งต่อไปนี้:
63.55 + 32.06 + (4 x 16) = 159.61 กรัมต่อโมล
หารมวลของตัวอย่างเกลือที่ปราศจากความร้อนของคุณโดยมวลโมเลกุลของสารประกอบแอนไฮเพื่อรับจำนวนโมลของสารประกอบ ในตัวอย่างของเรา 16 กรัม / 160 กรัมต่อโมล = 0.1 โมล
แบ่งมวลของน้ำที่สูญเสียไปเมื่อคุณอุ่นเกลือด้วยมวลโมลาร์ของน้ำประมาณ 18 กรัมต่อโมล ในตัวอย่างของเราเราสูญเสียน้ำ 9 กรัม ถ้าเราหาร 9 ด้วย 18 เราจะได้น้ำ 0.5 โมลหายไป
แบ่งจำนวนโมลของน้ำที่สูญเสียไปโดยจำนวนโมลของเกลือปราศจากน้ำเพื่อให้ได้อัตราส่วนของโมเลกุลน้ำต่อหน่วยสูตร ในตัวอย่างของเรา 0.5 โมลของน้ำ÷ 0.1 โมลคอปเปอร์ซัลเฟต = 5: 1 อัตราส่วน ซึ่งหมายความว่าสำหรับทุกหน่วยของ CuSO4 ปัจจุบันเรามี 5 โมเลกุลของน้ำ