เนื้อหา
- TL; DR (ยาวเกินไปไม่ได้อ่าน)
- สารละลายบัฟเฟอร์ที่เป็นกรดและด่าง
- หลักการ Le Chateliers
- การเพิ่มฐานไปยังโซลูชันบัฟเฟอร์
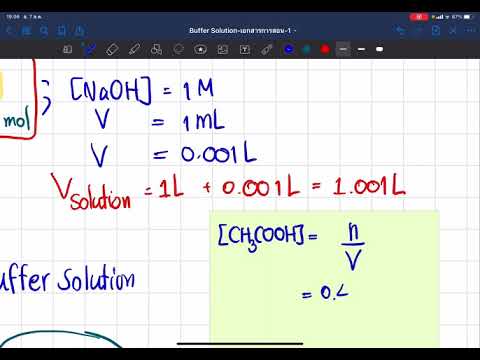
สารละลายบัฟเฟอร์คือสารละลายน้ำที่มีค่า pH คงที่ มันทำโดยการผสมในปริมาณมากของกรดอ่อนหรือฐานอ่อนแอกับฐานผันหรือกรด เมื่อคุณเพิ่มปริมาณของกรดหรือด่าง (เบส) ในปริมาณเล็กน้อยค่า pH ของมันจะไม่เปลี่ยนแปลงอย่างมีนัยสำคัญ กล่าวอีกนัยหนึ่งสารละลายบัฟเฟอร์จะหยุดกรดและเบสจากการทำให้เป็นกลางให้เป็นกลาง
TL; DR (ยาวเกินไปไม่ได้อ่าน)
เมื่อเพิ่มฐานในสารละลายบัฟเฟอร์ค่า pH จะไม่เปลี่ยนแปลง สารละลายบัฟเฟอร์ช่วยป้องกันไม่ให้กรดเป็นกลาง
สารละลายบัฟเฟอร์ที่เป็นกรดและด่าง
ระดับค่า pH แสดงให้เห็นว่ากรดหรือด่างเป็นสารละลายที่มีน้ำเป็นส่วนประกอบ สารละลายที่เป็นกรดจะมีไอออนของไฮโดรเจนมากกว่าไฮดรอกไซด์ไอออนในขณะที่สารละลายอัลคาไลน์จะมีไอออนไฮดรอกไซด์มากกว่าไอออนไฮโดรเจน ในระดับ 0 ถึง 14 โดยที่ 0 ถึงด้านซ้ายและ 14 ทางด้านขวาสารละลายบัฟเฟอร์ที่เป็นกรดจะมีระดับความเป็นกรดด่างน้อยกว่า 7 โดยทั่วไปจะทำจากกรดอ่อนและฐานผัน - มักจะเป็นเกลือโซเดียม สารละลายบัฟเฟอร์อัลคาไลน์มีระดับ pH มากกว่า 7 และมักจะทำจากฐานที่อ่อนแอและหนึ่งในเกลือของมัน ในการเปลี่ยนค่า pH ของสารละลายบัฟเฟอร์เปลี่ยนอัตราส่วนของกรดเบสเป็นเกลือหรือเลือกกรดหรือเบสที่แตกต่างและเกลือหนึ่งในนั้น
หลักการ Le Chateliers
Le Chateliers Principle ช่วยให้คุณทำงานสิ่งที่เกิดขึ้นในสารละลายบัฟเฟอร์ หลักการระบุว่าถ้าคุณเปลี่ยนเงื่อนไขของดุลยภาพแบบไดนามิกตำแหน่งของดุลยภาพจะเคลื่อนไหวเพื่อต่อต้านการเปลี่ยนแปลง ตัวอย่างเช่นในสารละลายบัฟเฟอร์ที่เป็นกรดของกรดเอทาโนอิคและโซเดียมเอทาโนอาเตตตำแหน่งของสมดุลนั้นอยู่ทางซ้ายบนสเกลเพราะเอธาโนนิกเป็นกรดอ่อน เมื่อคุณเพิ่มโซเดียมเอทาโนเนตซึ่งเป็นฐานผันคุณเพิ่มไอออนอีทาโนเอตพิเศษจำนวนมากซึ่งจะแนะนำตำแหน่งของสมดุลให้ยิ่งขึ้นไปทางซ้าย
การเพิ่มฐานไปยังโซลูชันบัฟเฟอร์
หากคุณเพิ่มฐานลงในสารละลายบัฟเฟอร์ความเข้มข้นของไอออนไฮโดรเจนจะลดลงน้อยกว่าจำนวนที่คาดไว้สำหรับปริมาณฐานที่เพิ่ม กรดและเบสคอนจูเกตใช้อิออนไฮดรอกไซด์ ค่า pH ของสารละลายไม่เพิ่มขึ้นอย่างมีนัยสำคัญซึ่งจะทำถ้าระบบบัฟเฟอร์ไม่ได้ใช้งาน นี่เป็นเพราะตามหลักการของ Le Chateliers ตำแหน่งของสมดุลย้ายไปทางขวาเพื่อชดเชยการสูญเสียของไฮโดรเจนไอออนในปฏิกิริยากับฐาน