เนื้อหา
ในทางเคมีของแข็งไอออนิกบางชนิดมีความสามารถในการละลายน้ำต่ำ สารบางชนิดละลายและก้อนของแข็งยังคงอยู่ ในการคำนวณว่าละลายเท่าไหร่คุณต้องใช้ KSPค่าคงที่ของผลิตภัณฑ์การละลายพร้อมกับการแสดงออกที่ได้จากปฏิกิริยาการละลายสมดุลสำหรับสาร
กำหนดปฏิกิริยาการละลาย
เขียนสมการปฏิกิริยาการละลายอย่างสมดุลสำหรับสารที่คุณสนใจนี่คือสมการที่อธิบายสิ่งที่เกิดขึ้นเมื่อส่วนที่เป็นของแข็งและส่วนที่ละลายนั้นไปถึงจุดสมดุล เพื่อนำตัวอย่างฟลูออไรด์ตะกั่ว PbF2ละลายเป็นตะกั่วและฟลูออไรด์ไอออนในปฏิกิริยาย้อนกลับ:
PBF2 ⇌หน้า2+ + 2F-
โปรดทราบว่าประจุบวกและลบต้องสมดุลทั้งสองด้าน โปรดทราบด้วยว่าแม้ว่าตะกั่วจะมีประจุ +2 แต่ฟลูออไรด์ก็มี -1 ในการปรับสมดุลค่าใช้จ่ายและอธิบายจำนวนอะตอมของแต่ละองค์ประกอบคุณจะต้องคูณฟลูออไรด์ทางด้านขวาด้วยสัมประสิทธิ์ 2
กำหนดสมการ Ksp
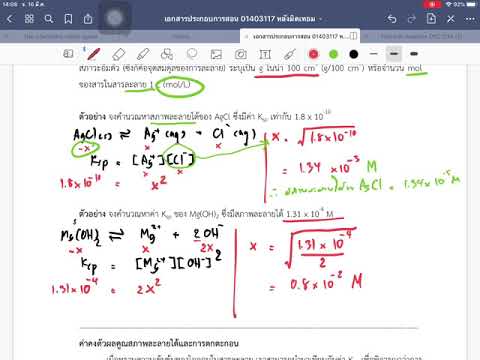
ค้นหาค่าคงที่ของผลิตภัณฑ์การละลายสำหรับสารที่คุณสนใจหนังสือเคมีและเว็บไซต์มีสารไอออนิกและตารางค่าคงที่ของการละลาย เพื่อทำตามตัวอย่างของฟลูออไรด์ตะกั่ว KSP คือ 3.7 x 10-8. รูปนี้ไปทางด้านซ้ายของ KSP สมการ ทางด้านขวาคุณแบ่งไอออนแต่ละตัวออกเป็นวงเล็บเหลี่ยม โปรดทราบว่าไอออน polyatomic จะได้รับวงเล็บของตัวเองคุณจะไม่แยกมันออกเป็นองค์ประกอบแต่ละอย่าง สำหรับไอออนที่มีค่าสัมประสิทธิ์สัมประสิทธิ์จะกลายเป็นพลังงานดังเช่นในนิพจน์ต่อไปนี้:
KSP= 3.7 x 10-8 = 2
ทดแทนและแก้ไข
การแสดงออกข้างต้นเท่ากับค่าคงที่ของผลิตภัณฑ์การละลาย Ksp กับไอออนที่ละลายสองตัว แต่ยังไม่ได้ให้ความเข้มข้น ในการค้นหาความเข้มข้นให้แทนที่ X สำหรับแต่ละไอออนดังนี้:
KSP= 3.7 x 10-8 = (X) (X)2
สิ่งนี้จะถือว่าไอออนแต่ละตัวมีความแตกต่างกันซึ่งทั้งสองอย่างนี้มีโมลาสมาธิเข้มข้นและผลิตภัณฑ์ของโมลาริตี้เหล่านั้นเท่ากับ KSPค่าคงที่ของการละลาย อย่างไรก็ตามไอออนที่สอง (F) นั้นแตกต่างกัน มันมีค่าสัมประสิทธิ์ 2 ซึ่งหมายความว่าแต่ละฟลูออไรด์ไอออนนับแยกต่างหาก หากต้องการบัญชีนี้หลังจากการแทนที่ด้วย X ให้ใส่สัมประสิทธิ์ไว้ในวงเล็บ:
KSP= 3.7 x 10-8 = (X) (2X)2
ตอนนี้แก้ปัญหาสำหรับ X:
3.7 x 10-8 = (X) (4X2)
3.7 x 10-8 = 4X3
X = .0021 M
นี่คือความเข้มข้นของสารละลายในโมลต่อลิตร
กำหนดจำนวนเงินที่ละลาย
เพื่อหาปริมาณของสารที่ละลายให้คูณด้วยน้ำลิตรแล้วคูณด้วยมวลโมลาร์ ตัวอย่างเช่นหากสารของคุณละลายในน้ำ 500 มล., 0.0021 โมลต่อลิตรคูณด้วย 0.5 ลิตรเท่ากับ. 00105 โมล จากตารางธาตุมวลอะตอมเฉลี่ยของตะกั่วอยู่ที่ 207.2 และฟลูออรีนเท่ากับ 19.00 เนื่องจากโมเลกุลของฟลูออไรด์ตะกั่วมี 2 อะตอมของฟลูออรีนจึงเพิ่มมวลของมันเป็น 2 เพื่อให้ได้ 38.00 มวลโมลาร์รวมของตะกั่วฟลูออไรด์เท่ากับ 245.20 กรัมต่อโมล เนื่องจากสารละลายของคุณมี. 0021 โมลของสารที่ละลาย, 0.0021 โมลคูณ 245.20 กรัมต่อโมลจึงให้ตะกั่วและฟลูออไรด์ไอออนที่ละลายได้เท่ากับ. 515 กรัม